
 PEAKS AB 抗体测序服务
PEAKS AB 抗体测序服务
PEAKS AB 服务介绍
基于 PEAKS AB 分析平台为核心的抗体测序服务核心优势:
- 快速:1-3周工作周期
- 全长深度覆盖:每个氨基酸被映射到超过20条多肽和100%的序列覆盖
- 精确:CDR区的每个氨基酸在至少10张二级谱图中由成对的碎片离子提供可靠的证据。
- 完整分子量验证:重链和轻链的分子量检测结果,对于从头测序组装和C末端赖氨酸缺失提供多重确证。
- 亮氨酸和异亮氨酸鉴别的三重验证:通过优化的EThcD碎裂模式下的质谱采集方法,酶解特异性和独家的抗体序列数据库同源比对分析,从三个水平对亮氨酸和异亮氨酸进行确证。
- 用户友好的报告:来自蛋白质谱数据分析业内著名软件PEAKS的交互视图,提供序列细节确证的直观呈现。
BSI已经开发了拥有专利的抗体蛋白从头测序技术,基于我们的PEAKS AB软件,无需提供杂交瘤细胞,可以直接对抗体进行测序。PEAKS AB抗体测序服务包括所有物种、同种和异种的全长重链和轻链抗体测序。从我们的抗体蛋白测序服务中获得的众多成功案例已经证实了100%的准确性和100%的覆盖率。
PEAKS AB 服务内容
| 提供样品及要求 | 服务内容 | |
|---|---|---|
| 抗体蛋白从头测序服务 | 单抗样品 (≥0.1mg,80%以上纯度) | • 抗体序列全长 • 亮氨酸/异亮氨酸鉴别(可选) • 完整的PEAKS AB报告 • 原始数据(可选) |
| 亮氨酸/异亮氨酸鉴别服务 | 纯化的蛋白样品 (≥50µg,95%以上纯度) 蛋白序列 | • 通过EThcD质谱进行亮氨酸和异亮氨酸区分鉴定 |
如果您的样品不符合上述所有标准(数量有限,低纯度或混合样品,稀有物种或改造过的抗体),请先与我们联系。我们可以提供个性化解决方案。
Ile/Leu 鉴别区分
虽然异亮氨酸(Ile)和亮氨酸(Leu)具有完全相同的分子量,但它们不同的结构可能会显著影响蛋白质的功能。为了对您感兴趣的蛋白质准确地测序,特别是治疗性蛋白质,必须谨慎地确证蛋白质序列中的每个Ile/Leu位置。特别是,对于抗体CDR区域内及附近的Ile/Leu残基,在Ile/Leu之间切换可能导致其生化特性的显著差异。
我们的Ile/Leu鉴定区分服务在蛋白质测序过程中提供了Ile和Leu残基的精确鉴定,并帮助显著降低随后表达阶段的成本。例如,一个含有4个未确定的Ile/Leu残基的目标蛋白需要多达16个蛋白表达构建体的表达产物来最终检测验证哪个残基是正确的。这甚至没有把密码子组合考虑在内。我们的Ile/Leu差异化服务,使您不再需要猜测和反复测试,直接100%确定,甚至帮您发现序列中的潜在突变。
亮氨酸和异亮氨酸鉴别的三重验证
- 传统的MS通常认为Ile和Leu残基无法区分,但是,某些质谱方法产生的异亮氨酸和亮氨酸的w离子可以将它们区分开来。1,2,3

- (可选)由于酶切的特异性,因此酶的使用作为一种诊断和研究工具也是很重要的。利用酶的酶切规律,我们可以用胰凝乳蛋白酶或胃蛋白酶等酶来区分Ile/Leu残基;
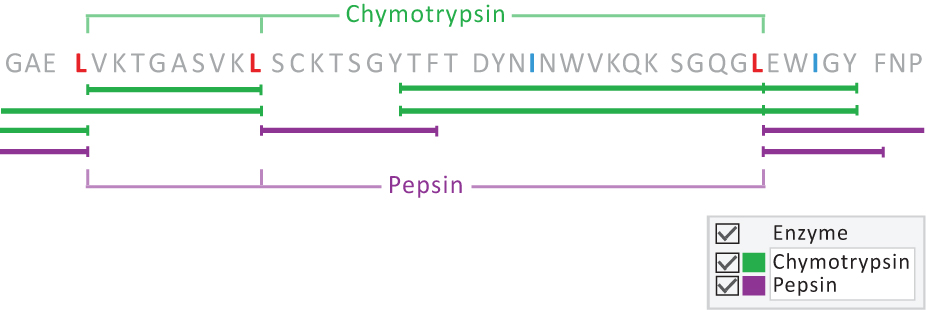
- PEAKS特有的抗体数据库中,根据同源抗体恒定区和骨架区(FR)保守位点的统计比较提供亮氨酸和异亮氨酸的参考。
抗体测序原理介绍
基于20年以上在质谱数据分析方面的专业知识,我们的团队不断完善自主研发的抗体测序流程和软件。我们的标准程序结合bottom-up和top-down的质谱技术来构建和验证de novo蛋白序列,包括以下步骤:
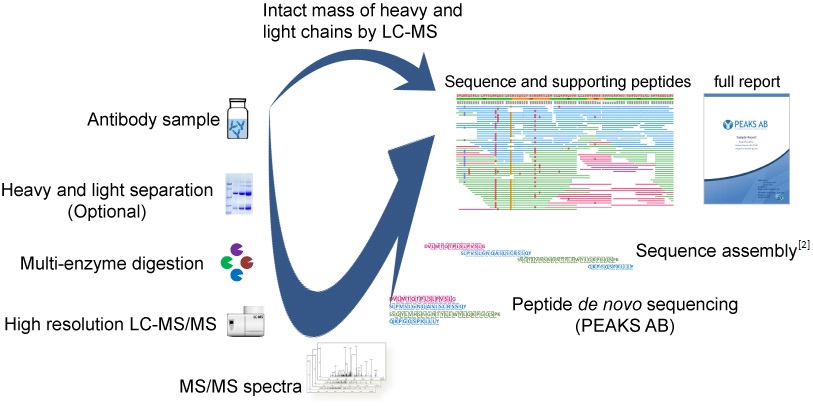
Bottom-up测序流程
- 利用一组优化后的正交酶解方案酶解抗体蛋白产生具有重叠片段的多肽
- 高分辨率LC-MS/MS(Thermo Orbitrap系列质谱仪)分析多肽
- 串联质谱的肽从头测序
- 通过从头测序多肽序列的组装来构建抗体序列。
- Ile/Leu的鉴别采用先进的EThcD MS方法,酶切特异性和同源数据库分析的三重验证。
- 由我们的质谱和数据科学家人工确认和生成报告。
完整分子量验证流程
- 还原处理抗体蛋白,分离轻链和重链。
- 通过PNGase F糖苷酶水解处理重链的N-糖基化修饰
- 用LC-MS(Q-TOF质谱仪)分析轻重链混合物
- 对采集得到的质谱数据进行解卷积,分别得到轻链和重链的质量
- 由我们的质谱和数据科学家人工确认和生成报告。
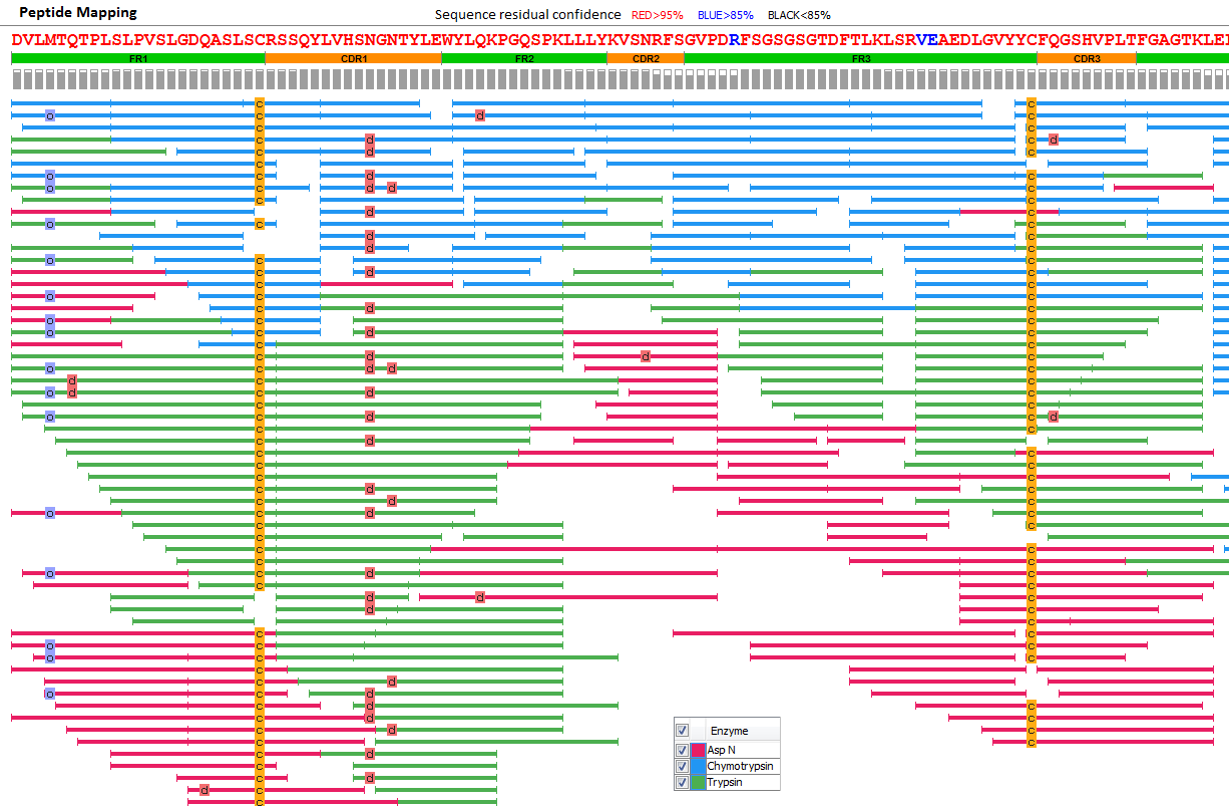
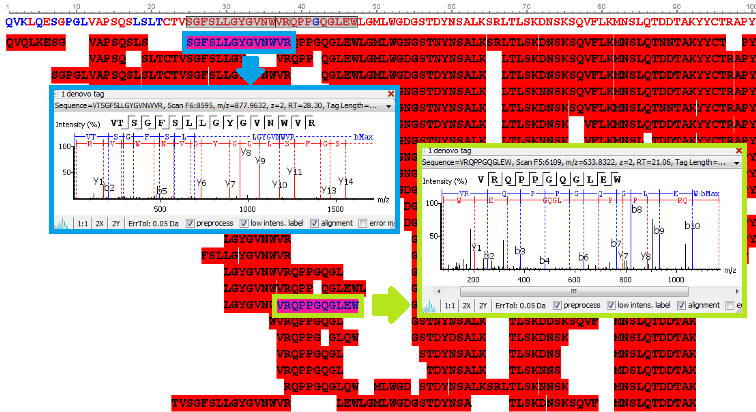
100% 序列覆盖
我们的抗体测序服务保证每个氨基酸通常被映射到超过20个不同的多肽上。左边所示肽图是使用我们的PEAKS AB软件在肽谱匹配水平上以0.1%的FDR得到的。序列下面的每个条表示从质谱/质谱数据中鉴定得到的多肽,颜色表示用于样品酶解的不同的酶。
100% 序列准确度
抗体蛋白测序服务基于从头测序结果在氨基酸水平进行质量控制。组装蛋白序列中的每个氨基酸都需要从二级质谱数据中获得直接的碎片离子证据。CDR区的每个氨基酸在至少10张二级谱图中由成对的碎片离子提供可靠的证据。
完整分子量验证
重链和轻链的完整分子量的测量用于从头测序肽段组装的抗体序列的双重确认,N端焦谷氨酸化修饰,重链C端赖氨酸缺失和N-糖分析。

联系我们 — 中国代理
微信关注

上海豆谷信息科技有限公司
电话:+86-21-54155562
邮件:sales@wandougu.com
QQ:1211316140
地址:上海市松江区沪松公路1399弄69号718
快速留言
[fluentform id=”19″]
参考文献
- Johnson, R. S., Martin, S., Biemann, K., Stults, J. T., & Watson, J. T. Novel fragmentation process of peptides by collision-induced decomposition in a tandem mass spectrometer: differentiation of leucine and isoleucine. Anal Chem. 1987 Nov 1;59(21):2621-5.
- Xiao, Y., Vecchi, M. M., & Wen, D. Distinguishing between Leucine and Isoleucine by Integrated LC-MS Analysis using an Orbitrap Fusion Mass Spectrometer. Anal Chem. 2016 Nov 1;88(21):10757-10766.
- Zhokhov, S. S., Kovalyov, S. V., Samgina, T. Y., & Lebedev, A. T. An EThcD-Based Method for Discrimination of Leucine and Isoleucine Residues in Tryptic Peptides. J Am Soc Mass Spectrom. 2017 Aug;28(8):1600-1611.
- Shan, B. and Xin, L. Integrating de novo Sequencing and Database Search for Monoclonal Antibody Sequencing. J Biomol Tech. 24(Suppl). S62–S63. 1/5/2013.
- Tran, N.H. et al. Complete De Novo Assembly of Monoclonal Antibody Sequences. Sci Rep. 6:31730. 26/08/2016.

